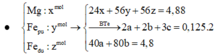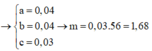1/ Cho 13,2(g) hỗn hợp X gồm hai kim loại M và Cu (M chiếm 21,95% về khối lượng ) vào 100g dung dịch H2SO4 98% đun nóng. Kết thúc phản ứng thu được dung dịch Y và 6,72(l) SO2 (đktc). Tìm kim loại M và C%của CuSO4 trong dung dịch Y
2/ Cho hỗn hợp 9,1g Cu và Al vào H2SO4 đặc, nguội dư thu được 2,24(l) khí (đktc) . Tính % số mol Al trong hỗn hợp ban đầu